藥物檢測(cè):目標(biāo)生長(zhǎng)曲線確定孵育孔中對(duì)應(yīng)的濃度梯度
目前,通過透射光強(qiáng)的變化模擬細(xì)菌生長(zhǎng)狀態(tài)的變化,從而判斷孵育孔內(nèi)藥物是否具有殺菌或抑菌效果。
但是將細(xì)菌樣本加入藥敏板多個(gè)孵育孔內(nèi),由于藥敏板中每個(gè)孵育孔本體透光率不同從而引入誤差,再加上光學(xué)系統(tǒng)也不是同一個(gè)系統(tǒng),會(huì)引入光強(qiáng)值讀取誤差;因此,會(huì)導(dǎo)致細(xì)菌樣本在多個(gè)孔內(nèi)的生長(zhǎng)狀態(tài)接近,但是由于上述兩個(gè)原因疊加的誤差,也會(huì)得相差較大的透射光強(qiáng)數(shù)據(jù),對(duì)于儀器的判讀標(biāo)準(zhǔn)的制定是非常不利的,從而影響了藥敏測(cè)試的準(zhǔn)確性。
因此,亟需一種藥敏檢測(cè)方法,能夠有效提高藥敏測(cè)試的準(zhǔn)確性。
藥敏檢測(cè)方法包括以下步驟:
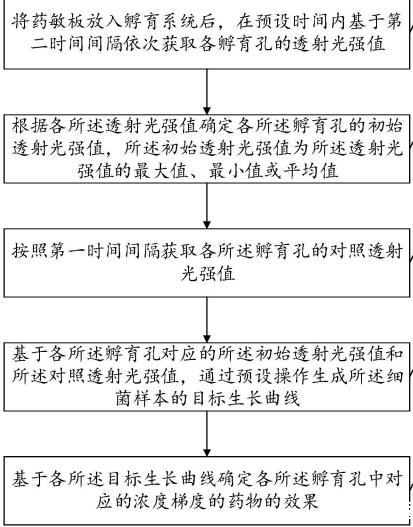
獲取藥敏板各孵育孔的初始透射光強(qiáng)值,各所述孵育孔內(nèi)有不同種類和/或不同濃度梯度的藥物。
應(yīng)理解的是,在獲取藥敏板各孵育孔的初始透射光強(qiáng)值之前,還包括將細(xì)菌樣本和培養(yǎng)基接種于藥敏板的多個(gè)孵育孔。
在具體實(shí)現(xiàn)中,可以從待測(cè)臨床樣品平板上挑取單菌落作為細(xì)菌樣本;將所述細(xì)菌樣本接種于培養(yǎng)基中獲得培養(yǎng)基混合液,并將所述培養(yǎng)基混合液接種于藥敏板的多個(gè)孵育孔。
需要說明的是,將細(xì)菌樣本和培養(yǎng)基接種于藥敏板的多個(gè)孵育孔可以是通過人工操作的方式、獨(dú)立裝置點(diǎn)樣的方式或集成式點(diǎn)樣的方式,也可以是其他接種方式,本實(shí)施例對(duì)此不加以限制。
需要說明的是,細(xì)菌等微生物感染會(huì)引發(fā)多種疾病,不僅發(fā)病率高而且經(jīng)常引發(fā)危重癥,嚴(yán)重危害人類健康和生命。因此,研究各類微生物感染疾病對(duì)應(yīng)濃度梯度的抑菌或殺菌藥物是臨床醫(yī)學(xué)領(lǐng)域的重要問題。
可理解的是,在相關(guān)技術(shù)中,針對(duì)細(xì)菌等微生物的檢測(cè)任務(wù)包括有臨床藥敏檢測(cè),臨床藥敏檢測(cè)是為了檢測(cè)抗菌藥物的MIC(MinimumInhibitoryConcentration,最低抑菌濃度)值,該數(shù)據(jù)有助于改善患者的預(yù)后和防止耐藥性微生物菌株的演變。確定最低抑菌濃度值,需要對(duì)微生物進(jìn)行準(zhǔn)確有效的計(jì)數(shù)。以細(xì)菌為例,傳統(tǒng)的細(xì)菌計(jì)數(shù)方法包括比濁法、菌落計(jì)數(shù)法、計(jì)數(shù)器測(cè)定法等。
其中,比濁法是根據(jù)菌懸液的透光量間接地測(cè)定細(xì)菌的數(shù)量,細(xì)菌懸浮液的濃度在一定范圍內(nèi)于透光度成反比,與光密度成正比,此方法簡(jiǎn)單快捷。本實(shí)施例就是通過透射光強(qiáng)的變化模擬細(xì)菌等微生物的生長(zhǎng)狀態(tài)的變化,從而判斷孵育孔內(nèi)對(duì)應(yīng)濃度梯度的藥物是否具有殺菌或抑菌效果,從而指導(dǎo)用藥。
應(yīng)理解的是,上述藥敏板是用來做藥敏實(shí)驗(yàn)或者抗菌實(shí)驗(yàn)的瓊脂平板。
在具體實(shí)現(xiàn)中,可以從待測(cè)臨床樣品平板上挑取單菌落作為細(xì)菌樣本;將所述細(xì)菌樣本接種于培養(yǎng)基中獲得培養(yǎng)基混合液,并將所述培養(yǎng)基混合液接種于藥敏板的多個(gè)孵育孔,所述孵育孔內(nèi)有不同種類和不同濃度梯度的藥物。
需要說明的是,所述培養(yǎng)基選自BBL(美國BD公司)、Difco(美國BD公司)、Mueller-Hinton Broth(英國Oxoid公司)和Iso Sensitest肉湯(英國Oxoid公司)中的至少一種。
所述培養(yǎng)基具體為2×BBL培養(yǎng)基(美國BD公司)、2×Difco(美國BD公司)、2×Mueller-Hinton Broth(英國Oxoid公司)和2×Iso Sensitest肉湯(英國Oxoid公司)中的至少一種。
在現(xiàn)有技術(shù)中將細(xì)菌樣本加入藥敏板多個(gè)孵育孔內(nèi),每個(gè)孵育孔本體透光率不同引入誤差,再加上光學(xué)系統(tǒng)也不是同一個(gè)系統(tǒng),也引入光強(qiáng)值讀取誤差;即便細(xì)菌樣本在多個(gè)孵育孔內(nèi)生長(zhǎng)狀態(tài)接近,由于以上兩個(gè)原因疊加的誤差,也會(huì)得相差較大的透射光強(qiáng)數(shù)據(jù)。
例如,以兩個(gè)孔對(duì)應(yīng)兩套光學(xué)系統(tǒng)為例,假設(shè)兩個(gè)孔的透光率分別為0.8,0.4,兩套光學(xué)系統(tǒng)原始光強(qiáng)分別為1000,800;孵育孔內(nèi)待檢測(cè)液的透光率4個(gè)時(shí)刻的變化值為0.9、0.8、0.6、0.3;那么對(duì)應(yīng)第一組孔與第一套光學(xué)系統(tǒng)得到的光強(qiáng)值變化為1000*0.8*0.9=720、1000*0.8*0.8=640、1000*0.8*0.6=480、1000*0.8*0.3=240;對(duì)應(yīng)第二組孔與第二套光學(xué)系統(tǒng)得到的光強(qiáng)變化為800*0.4*0.9=288、800*0.4*0.8=256、800*0.4*0.6=192、800*0.4*0.3=96。根據(jù)上述兩組數(shù)據(jù)同樣的樣本生長(zhǎng)趨勢(shì),得到了兩個(gè)完全不同的生長(zhǎng)曲線,對(duì)于儀器的判讀標(biāo)準(zhǔn)的制定是非常不利的,從而影響了藥敏測(cè)試的準(zhǔn)確性。
目標(biāo)生長(zhǎng)曲線;基于各所述目標(biāo)生長(zhǎng)曲線確定各所述孵育孔中對(duì)應(yīng)的濃度梯度的藥物的效果。由于本實(shí)施例將藥敏板放入孵育系統(tǒng)后,在預(yù)設(shè)時(shí)間內(nèi)基于第二時(shí)間間隔依次獲取各孵育孔的透射光強(qiáng)值;根據(jù)各透射光強(qiáng)值確定各孵育孔的初始透射光強(qiáng)值,初始透射光強(qiáng)值為所述透射光強(qiáng)值的最大值、最小值或平均值;然后基于各所述孵育孔對(duì)應(yīng)的初始透射光強(qiáng)值和對(duì)照透射光強(qiáng)值,通過預(yù)設(shè)操作生成細(xì)菌樣本的目標(biāo)生長(zhǎng)曲線,最后基于各目標(biāo)生長(zhǎng)曲線確定各孵育孔中對(duì)應(yīng)的濃度梯度的藥物的效果,相比于現(xiàn)有技術(shù),本實(shí)施例可以有效降低檢測(cè)過程中偶然性帶來的偏差,進(jìn)一步提高了藥敏檢測(cè)的準(zhǔn)確性。
相關(guān)新聞推薦
1、忍冬提取液對(duì)酸土脂環(huán)酸芽孢桿菌生長(zhǎng)曲線、細(xì)胞形態(tài)和生物膜形成能力的影響(一)
2、PlcR在炭疽芽胞桿菌A16R中對(duì)其生長(zhǎng)狀態(tài)、溶血酶活性及神經(jīng)磷脂酶活性影響(一)
3、耐鹽反硝化細(xì)菌NA2-1最適生長(zhǎng)條件、除氮效果
4、鵪鶉肺炎克雷伯菌血清型鑒定、耐藥性檢測(cè)及致病潛力(三)
5、微生物生長(zhǎng)曲線監(jiān)測(cè)系統(tǒng):12種LAB發(fā)酵物對(duì)霉菌生長(zhǎng)的抑制作用
