微生物生長曲線監測儀測定納米銀對副溶血弧菌的最小抑菌濃度(二)
1.3河口水樣的采集、分析與處理
河口水采樣點信息如表1所示,采集時間為2022年4月和12月,方法參照Das等的報道。簡而言之,使用4 L柱式聚乙烯采水器在水面下10~15 cm處采集,然后裝在潔凈玻璃瓶中于室溫下運輸到實驗室。為去除自然菌群的干擾,樣品到達實驗室后在121℃下滅菌30 min。然后于室溫下密閉保存,使用前搖勻。
1.4EMGA法測定
如圖1所示,EMGA法測定Ag NPs在河口水中抑菌效應的操作包括2個步驟:1)副溶血弧菌急性暴露于Ag NPs之后,暴露混合液加入預裝有LB液體表1采樣點經緯度信息培養基的檢測管中;2)檢測管置入EMGA中測定存活細胞的生長動力學曲線,從而示出最小抑菌濃度(minimum inhibitory concentration,MIC)。
具體如下:將10 8 CFU/mL副溶血弧菌接種到滅菌處理過的河口水樣品中,使其終濃度為10 5 CFU/mL。然后各取10 mL分裝入6個15 mL離心管中。分別加入倍比質量的Ag NPs,使該納米材料的終濃度分別為0、1.5、3.0、6.0、12.0、24.0和48.0 mg/L。室溫下,150 r/min輕搖離心管30 min,然后各取200μL暴露作用后的混合液分別注入預裝有1.8 mL LB液體培養基的檢測管(外徑5 mm,NORELL公司,美國)中。以滅菌LB液體培養基作為陰性對照,同樣裝入檢測管。將每個檢測管分別插入EMGA的一個工作通道中,開啟儀器,設置參數——激勵電壓12 V、激勵頻率400 MHz、采集周期1 min和采集次數1 200,點擊“開始”鍵,EMGA即實時呈現所有檢測管中細菌生長的動力學(ΔC 4-t)曲線。測定結束后,根據是否出現反正弦型生長曲線直接讀出生理鹽水中Ag NPs對副溶血弧菌的MIC值。
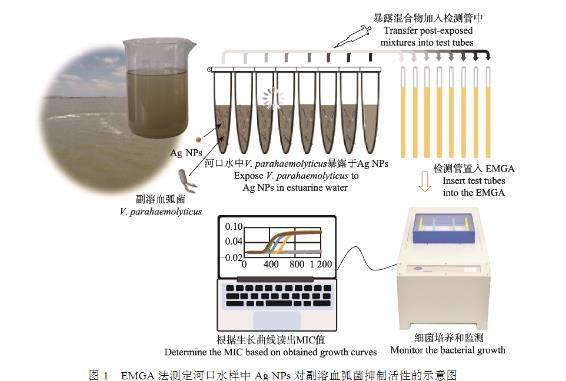
圖1 EMGA法測定河口水樣中Ag NPs對副溶血弧菌抑制活性的示意圖
1.5BMD法測定
根據CLSI規定的BMD方法測定河口水中Ag NPs對副溶血弧菌的抑制效應。10 5 CFU/mL副溶血弧菌急性暴露于Ag NPs之后,將混合物裝入離心管中,采用Optima XL-90型離心機(貝克曼庫爾特公司,美國)處理5 min(3 000 r/min)以去除影響結果判斷的懸浮顆粒。然后,各取20μL暴露作用后的混合液分別注入預裝有180μL LB液體培養基的96孔板(Biosense微生物生長動態監測系統,丹麥)中。用封口膜封住96孔板以防蒸發。將96孔板放在培養箱中于36℃下培養20 h,取出后,通過肉眼觀察是否渾濁判斷是否有菌生長增殖,進而讀出MIC值。
1.6平板計數法
測定參照Feng等報道的平板計數法測定河口水中Ag NPs對副溶血弧菌的抑制效應。10 5 CFU/mL副溶血弧菌急性暴露于Ag NPs之后,如無特殊說明,采用1.5部分述及的離心法除去混合物中的懸浮顆粒。然后,采用移液器各取100μL暴露作用后的混合液,10倍梯度稀釋后,分別均勻涂在LB瓊脂平板上。瓊脂平板加蓋后,在培養箱中于36℃下靜止培養過夜,取出后,通過觀察是否有菌斑生成判斷細菌是否被完全抑制,進而判斷出MIC值。
1.7數據處理與分析
以BMD法或平板計數法所測定的MIC值為相對標準,采用基本符合(EA)率值考察EMGA法測定Ag NPs抑菌活性的有效性。即將EMGA法測定的Ag NPs對副溶血弧菌的MIC值與平板計數法或BMD法所測定的MIC值比較,如果正負相差不大于1倍,則視作基本符合(EA);如果正負相差大于1倍而不大于2倍,則視作小偏差(mE);如果正負相差大于2倍,則視作大偏差(ME)。為了驗證EMGA法的重現性和精密度,測定Ag NPs在河口水樣S1中抑菌效應的實驗做9個平行。采用Microsoft Excel2021處理數據以計算出平行實驗結果的平均值和標準差(SD)。
